MONALEESA 2 - MCK [1]
MONALEESA 2

Generalidades 1
MONALEESA 2 es un estudio clínico fase III, aleatorizado, doble ciego, controlado 1:1 (n=668) en mujeres posmenopáusicas con cáncer de mama recurrente o metastásico, HR +/ HER2-, que no habían recibido terapia sistémica previa para la enfermedad avanzada.
El grupo intervención recibió
KISQALI® + Letrozol (n=334)
El grupo control recibió
placebo + Letrozol (n=334)


Resultados de los criterios de valoración de clínica
Supervivencia libre de progresión (SLP) evaluada por el investigador
La mediana de la supervivencia libre de progresión se prolongó en 9.3 meses, de 16.0 meses (IC 95%: 13,4 a 18,2) para los pacientes que recibieron placebo más letrozol a 25.3 meses (IC 95%: 23,0 a 30,3) para los que recibieron KISQALI® más letrozol. 7
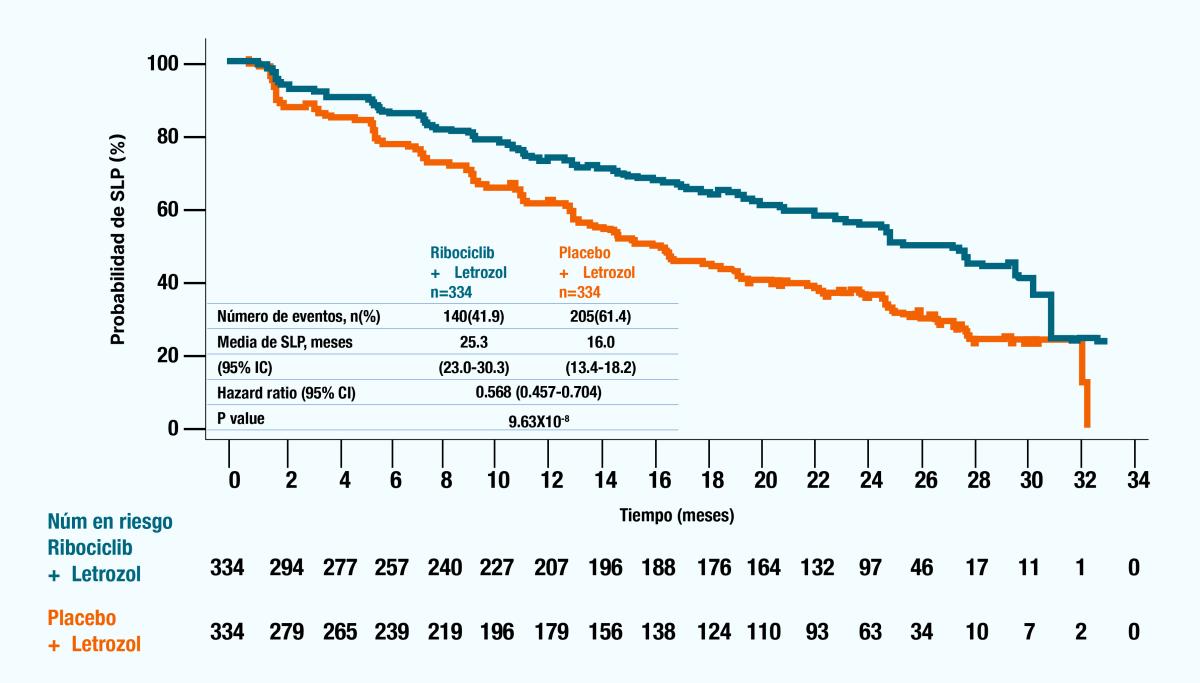
Figura 1. Gráfico de Kaplan-Meier de la SLP evaluada por el investigador para KISQALI® más letrozol versus placebo más letrozol. IC: intervalo de confianza; SLP, supervivencia libre de progresión. Corte de datos: 2 de enero de 2017.

Se observó un beneficio significativo en la supervivencia global, con una mediana de supervivencia global de 63,9 meses (IC del 95%: 52,4 a 71,0) en el grupo de KISQALI® y de 51,4 meses (IC del 95%: 47,2 a 59,7) en el grupo de placebo (índice de riesgo de muerte). , 0,76; IC del 95%, 0,63 a 0,93; bilateral P = 0,008). 1
La estimación de Kaplan-Meier de la supervivencia global a los 60 meses fue del 52,3% (IC del 95%: 46,5 a 57,7) en el grupo de ribociclib y del 43,9% (IC del 95%: 38,3 a 49,4) en el grupo de placebo y a los 72 meses fue del 44,2%. (IC del 95%, 38,5 a 49,8) y 32,0% (IC del 95%, 26,8 a 37,3), respectivamente. 1
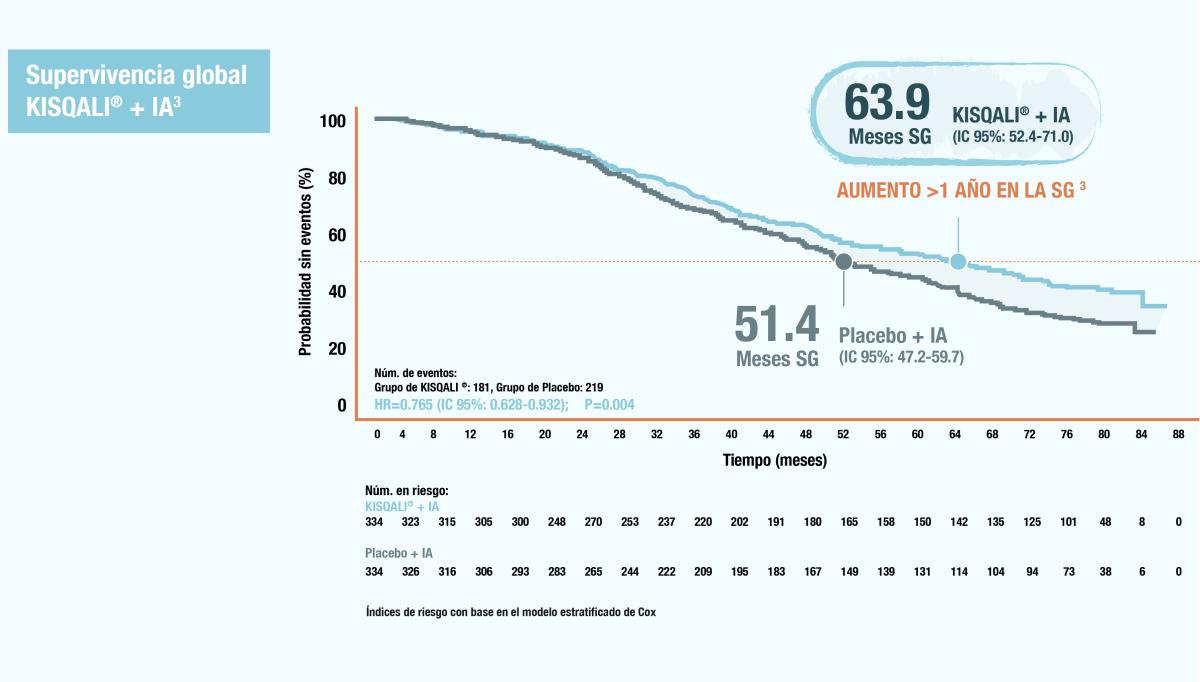
Figura 2. Supervivencia global
¿QUÉ SIGNIFICA PARA SUS PACIENTES 63.9 MESES DE MEDIANA DE SUPERVIVENCIA GLOBAL?
A los 6 años, la tasa de supervivencia de los pacientes fue: 1

Supervivencia global
Un análisis secundario del MONALEESA 2, en pacientes con enfermedad metastásica De Novo o con recurrencia tardía encontró un beneficio significativo tanto en la supervivencia global como en la supervivencia libre de progresión en el grupo con KISQALI®, donde se permitió la terapia (neo)adyuvante previa; sin embargo, para los pacientes que habían recibido previamente un IA (neo)adyuvante, en particular, se requirió un intervalo sin tratamiento >12 meses. 8
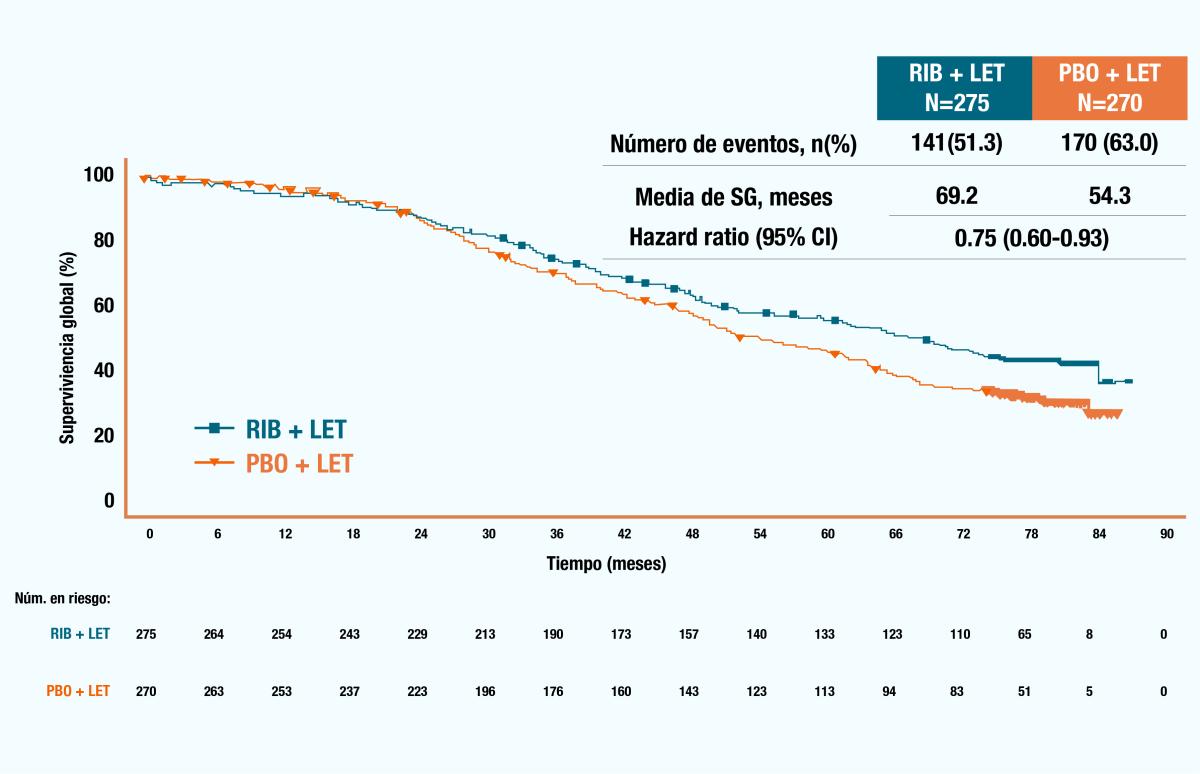
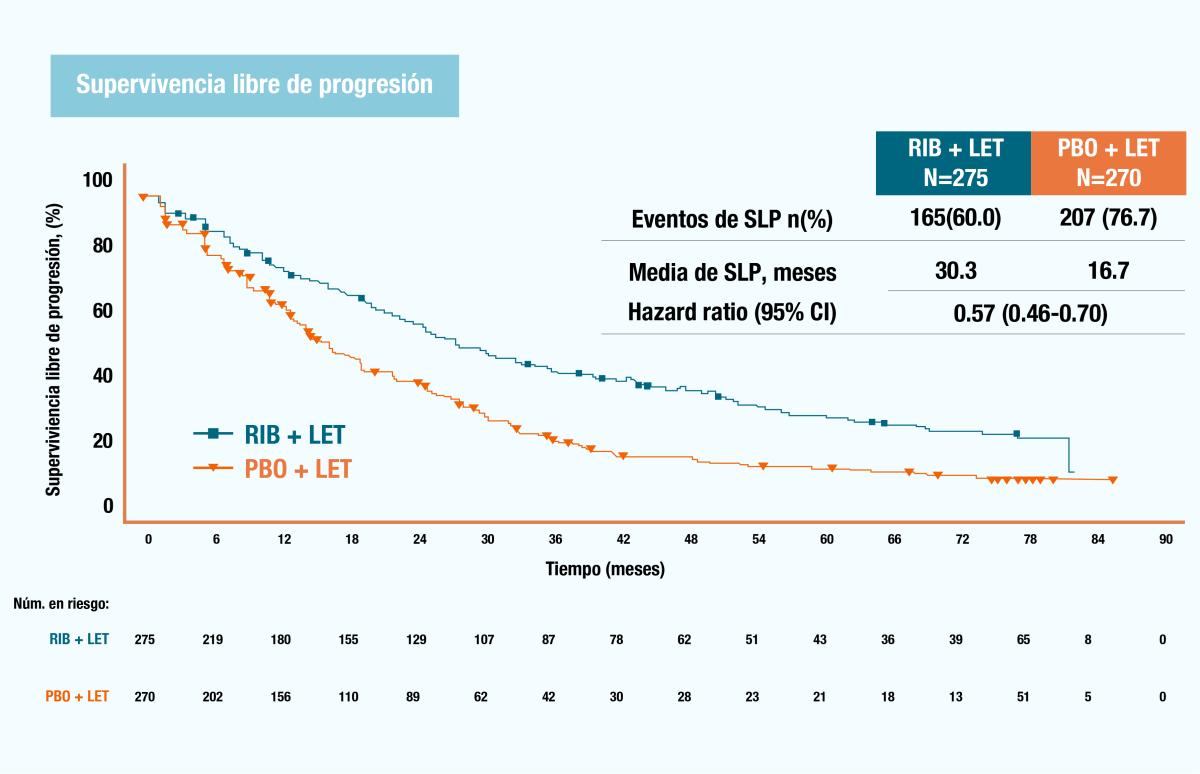
Figura 3. Gráfico de Kaplan-Meier de la supervivencia global (A) y supervivencia libre de progresión (B) en pacientes con enfermedad metastásica De Novo o con recurrencia tardía.
Quimioterapia
En los siguientes gráficos de Kaplan-Meier se muestra el tiempo hasta la primera quimioterapia y supervivencia sin quimioterapia en pacientes con enfermedad metastásica de novo o recurrencia tardía, observando un beneficio en el grupo con KISQALI® en ambas mediciones. 5
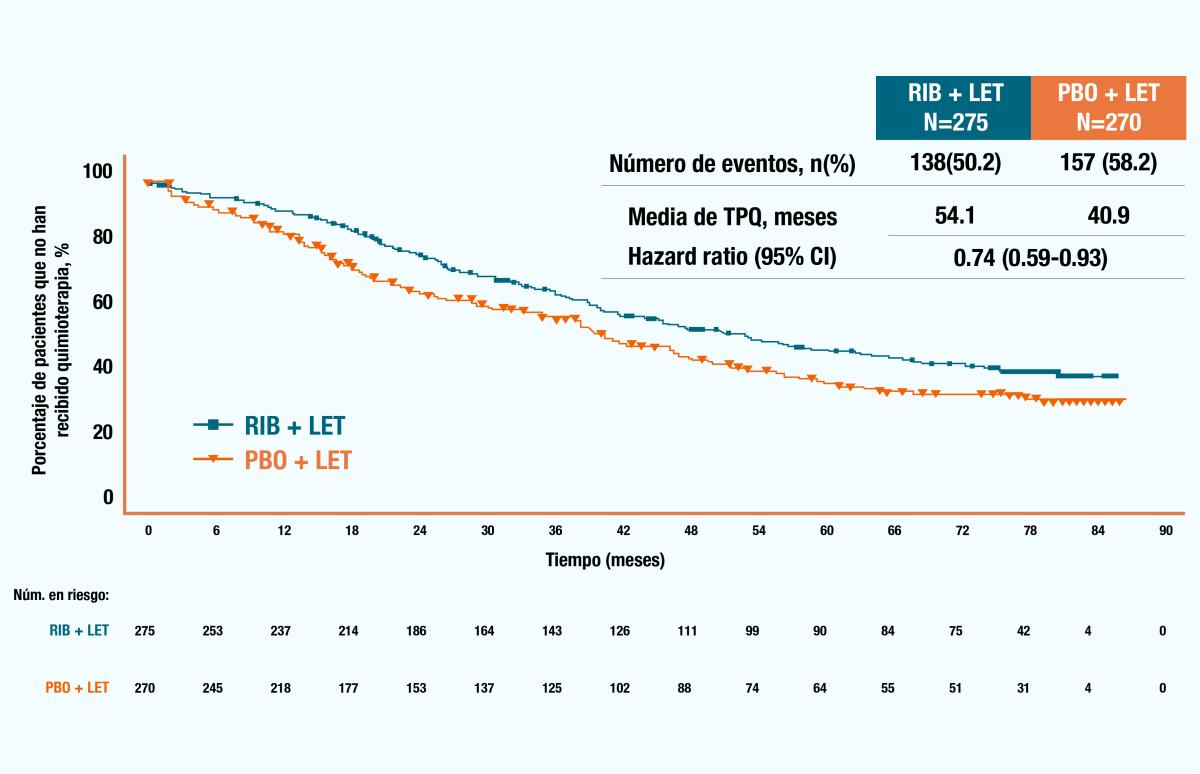
Figura 4. Gráfico de Kaplan-Meier del tiempo hasta la primera quimioterapia (TPQ).
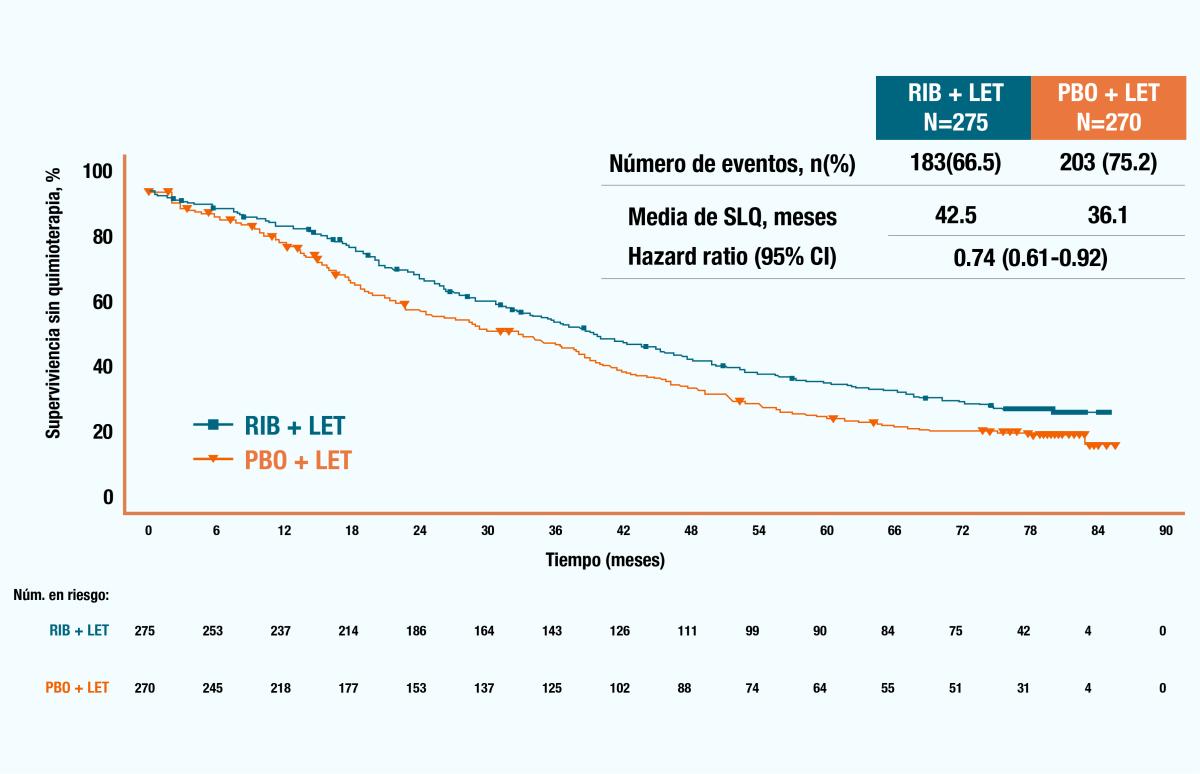
Figura 5. Gráfico de Kaplan-Meier de supervivencia libre de quimioterapia (SLQ)
Seguridad
En la siguiente tabla se muestran los efectos adversos (EA) más comunes, independientemente de la causalidad (20% en cualquier brazo de tratamiento). 5
| Eventos adversos, ≥20% en cualquier brazo de tratamiento. | RIB + LET n= 275 |
RIB + LET n= 267 |
||
|---|---|---|---|---|
| Cualquier Grado n (%) |
Grado 3/4 n (%) |
Cualquier Grado n (%) |
Grado 3/4 n (%) |
|
| Neutropenia | 182 (66.2) | 147 (53.5) | 15 (5.6) | 2 (0.7) |
| Náusea | 155 (56.4) | 8 (2.9) | 90 (33.7) | 3 (1.1) |
| Fatiga | 123 (44.7) | 9 (3.3) | 101 (37.8) | 3 (1.1) |
| Diarrea | 118 (42.9) | 7 (2.5) | 78(29.2) | 3 (1.1) |
| Artralgia | 117 (42.5) | 4 (1.5) | 118 (44.2) | 5 (1.9) |
| Alopecia | 102 (37.1) | 0 | 49 (18.4) | 0 |
| Vómito | 97 (35.3) | 12 (4.4) | 54 (20.2) | 3 (1.1) |
| Estreñimiento | 84 (30.5) | 3 (1.1) | 62 (23.2) | 0 |
| Dolor de cabeza | 82 (29.8) | 12 (0.7) | 66 (24.7) | 2 (0.7) |
| Dolor de espalda | 75 (27.3) | 11 (4.0) | 64 (24.0) | 4 (1.5) |
| Tos | 75 (25.5) | 0 | 72 (27.0) | 0 |
| Anemia | 70 (25.5) | 12 (4.4) | 22 (8.2) | 6 (2.2) |
| Sofoco | 67 (24.4) | 1 (0.4) | 72 (27.0) | 0 |
| Disminución de conteo de neutrófilos | 67 (22.5) | 53 (19.3) | 5 (1.9) | 1 (0.4) |
| Disminución de apetito | 62 (22.5) | 4 (1.5) | 52 (19.5) | 1 (0.4) |
| Hipertensión | 61 (22.2) | 44 (16.0) | 63 (23.6) | 46 (17.2) |
| Incremento de Aspartato aminotransferasa | 59 (21.5) | 18 (6.5) | 18 (6.7) | 2 (0.7) |
| Incremento de alanina aminotransferasa | 58 (21.1) | 32 (11.6) | 18 (6.7) | 3 (1.1) |
| Rash | 57 (20.7) | 3 (1.1) | 26 (9.7) | 1 (0.4) |
| Disminución de leucocitos | 57 (20.7) | 37 (13.5) | 5 (1.9) | 0 |
| Dolor en extremidades | 54 (19.6) | 0 | 55 (20.6) | 1 (0.4) |
Referencias
- Hortobagyi GN, Stemmer SM, Burris HA, Yap Y-S, Sonke GS, Hart L, et al. Overall survival with ribociclib plus letrozole in advanced breast cancer. N Engl J Med [Internet]. 2022;386(10):942–50. Available from: http://dx.doi.org/10.1056/nejmoa2114663 [2]
- Slamon DJ, Neven P, Chia S, Jerusalem G, De Laurentiis M, Im S, et al. Ribociclib plus fulvestrant for postmenopausal women with hormone receptor-positive, human epidermal growth factor receptor 2-negative advanced breast cancer in the phase III randomized MONALEESA-3 trial: updated overall survival. Ann Oncol [Internet]. 2021;32(8):1015–24. Available from: http://dx.doi.org/10.1016/j.annonc.2021.05.353 [3]
- Im S-A, Lu Y-S, Bardia A, Harbeck N, Colleoni M, Franke F, et al. Overall survival with ribociclib plus endocrine therapy in breast cancer. N Engl J Med [Internet]. 2019;381(4):307–16. Available from: http://dx.doi.org/10.1056/nejmoa1903765 [4].
- Finn, R. S. et al. Overall survival (OS) with first-line palbociclib plus letrozole (PAL+LET) versus placebo plus letrozole (PBO+LET) in women with estrogen receptor–positive/human epidermal growth factor receptor 2–negative advanced breast cancer (ER+/HER2− ABC): Analyses from PALOMA-2. J Clin Oncol 40, LBA1003 (2022).
- Llombart-Cussac, A. et al. Abstract PD13-11: PD13-11 Final Overall Survival Analysis of Monarch 2 : A Phase 3 trial of Abemaciclib Plus Fulvestrant in Patients with Hormone Receptor-Positive, HER2-Negative Advanced Breast Cancer. Cancer Res 83, PD13-11 (2023).
- Turner, N. C. et al. Overall Survival with Palbociclib and Fulvestrant in Advanced Breast Cancer. N Engl J Med 379, 1926-1936 (2018).
- Hortobagyi GN, Stemmer SM, Burris HA, Yap YS, Sonke GS, Paluch-Shimon S, et al. Updated results from MONALEESA-2, a phase III trial of first-line ribociclib plus letrozole versus placebo plus letrozole in hormone receptor-positive, HER2-negative advanced breast cancer. Ann Oncol [Internet]. 2018;29(7):1541–7.
- O’Shaughnessy J, Beck T, Chia S, Isaacs C, DeLaurentiis M, Kummel S,et. al. Efficacy and safety of first-line ribociclib + letrozole in patients with de novo metastatic disease and late recurrence from (neo)adjuvant therapy in MONALEESA-2 [Internet]. 2023. European Society for Medical Oncology Breast Cancer Congress. Available from: https://www.medicalcongress.novartisoncology.com/ESMOBC23/BC/pdf/OShaughnessy_196P_Poster.pdf#toolbar=0 [5]
- Slamon DJ, Neven P, Chia S, Fasching PA, De Laurentiis M, Im S-A, et al. Phase III randomized study of ribociclib and fulvestrant in hormone receptor–positive, human epidermal growth factor receptor 2–negative advanced breast cancer: MONALEESA-3. J Clin Oncol [Internet]. 2018;36(24):2465–72. Available from: http://dx.doi.org/10.1200/jco.2018.78.9909 [6]
- Tripathy D, Im S-A, Colleoni M, Franke F, Bardia A, Harbeck N, et al. Ribociclib plus endocrine therapy for premenopausal women with hormone-receptor-positive, advanced breast cancer (MONALEESA-7): a randomised phase 3 trial. Lancet Oncol [Internet]. 2018;19(7):904–15. Available from: http://dx.doi.org/10.1016/s1470-2045(18)30292-4 [7]
- Lu Y-S, Im S-A, Colleoni M, Franke F, Bardia A, Cardoso F, et al. Updated overall survival of ribociclib plus endocrine therapy versus endocrine therapy alone in pre- and perimenopausal patients with HR+/HER2− advanced breast cancer in MONALEESA-7: A phase III randomized clinical trial. Clin Cancer Res [Internet]. 2022;28(5):851–9. Disponible en: http://dx.doi.org/10.1158/1078-0432.ccr-21-3032 [8]
Material exclusivo para profesional de la salud. P3 MX2312061396 No. Aviso COFEPRIS 2309052002C00231 Fecha de vigencia: 26/12/2025
*Las imágenes no corresponden a pacientes reales.