La hidradenitis supurativa (HS) hace referencia a un proceso supurativo, crónico y doloroso que afecta la piel y el tejido subcutáneo de los pacientes.1
Las manifestaciones clínicas de la HS parecen ser el resultado de una oclusión folicular infrainfundibular y ruptura secundaria de la unión sebofolicular de las unidades foliculopilosebáceas (FPSU), lo que resulta en la activación de un proceso inflamatorio en cascada.1
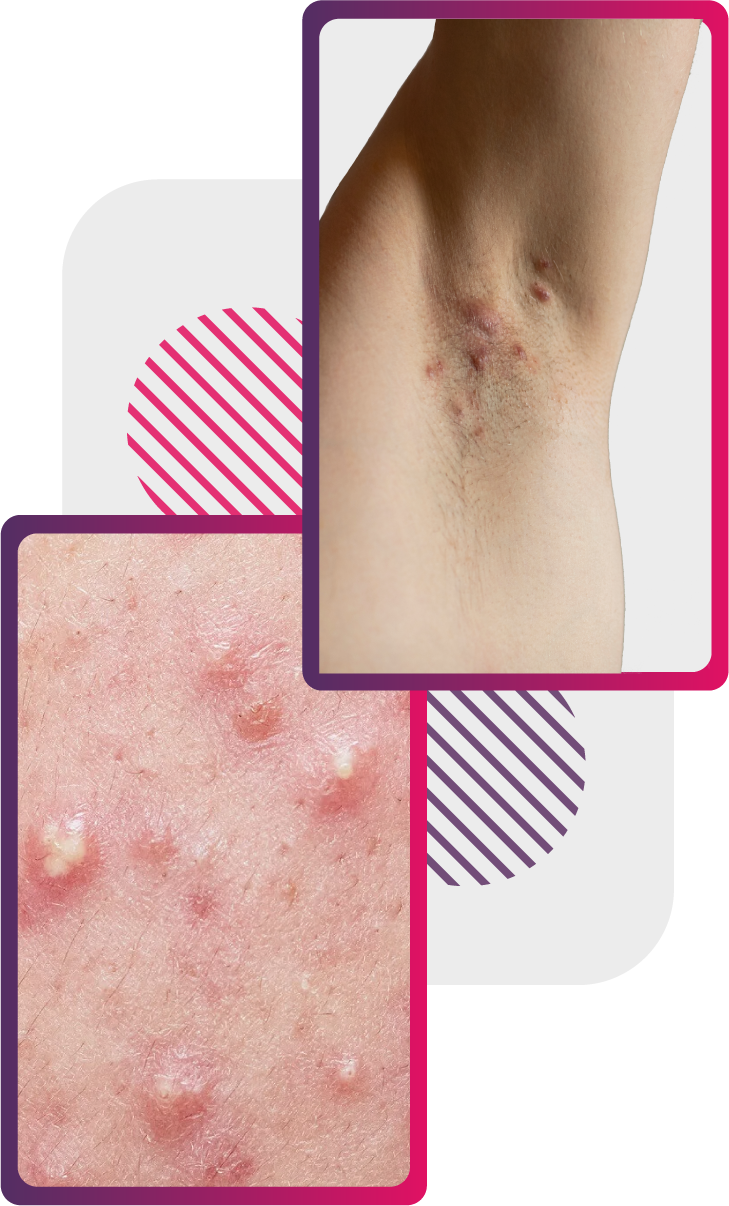
La piel que tiende a frotarse con frecuencia suele ser la más afectada en esta patología. La axila es el sitio más común pero también se puede encontrar en el área inguinal, la parte interna de los muslos, área perineal y perianal, la piel debajo de las mamas y las nalgas. En estas zonas podemos encontrar nódulos inflamados, dolorosos y recurrentes que pueden romperse y liberar material purulento.1
Estos nódulos pueden evolucionar a la formación de placas inflamatorias, túneles cutáneos epitelizados, comedones en etapa terminal y cicatrices en forma de cuerda.1

Los pacientes enlistados en el estudio fueron evaluados utilizando la escala de Hurley para analizar los estadios clínicos. Se obtuvieron tasas de 4.6% y 2.8%, en estadio 1; 61.4% y 56.7%, en estadio 2; 34.0% y 40.5% en estadio 3, respectivamente. Además, los pacientes tenían un diagnóstico de HS moderada a severa, durante un promedio de 7.3 años.2,3
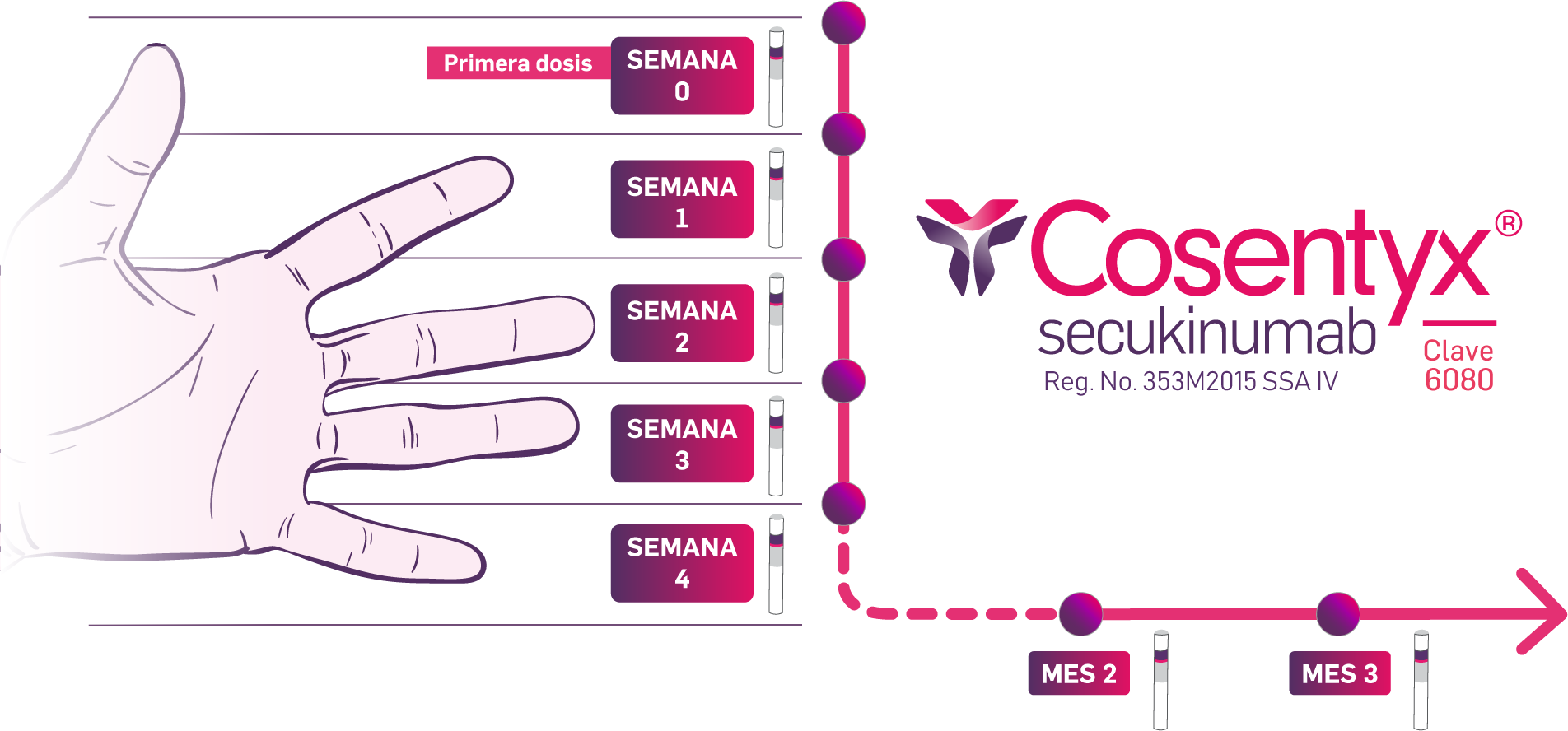
En el estudio SUNSHINE, el 23.8% de los pacientes previamente tratados con agentes biológicos lo discontinuaron por falta de eficacia o intolerancia. Por otro lado, en el estudio SUNRISE, se reportó que 23.2% de los pacientes interrumpió el tratamiento. En ambos estudios, los pacientes fueron aleatorizados (1:1:1) para recibir tratamiento con secukinumab 300 mg cada 2 semanas, secukinumab 300 mg SC cada 4 semanas, o placebo. Secukinumab y placebo se administraron por vía subcutánea.2,3
A la semana 16, (inicio del período 2 de tratamiento), los pacientes tratados con secukinumab continuaron con el mismo régimen, mientras que los pacientes asignados al grupo placebo se aleatorizaron para recibir secukinumab 300 mg cada 2 semanas o cada 4 semanas.2,3

A las 16 semanas, los pacientes tratados con 300 mg de secukinumab cada 2 semanas alcanzaron una respuesta HiSCR50, con una disminución significativa en el número de abscesos y nódulos inflamatorios, en comparación con placebo. En el estudio SUNSHINE, un numero significativamente menor de pacientes experimentaron reagudizaciones a la semana 16 con secukinumab 300 mg cada 2 semanas. Además, un número significativamente mayor de pacientes de ese mismo grupo experimentaron disminución clínicamente relevante del dolor relacionado a la enfermedad, en comparación al grupo placebo, a las 16 semanas (Tabla 1).2


Secukinumab mejoró la calidad de vida relacionada con la salud a lo largo de 52 semanas, tanto en el estudio SUNSHINE como en SUNRISE, según las evaluaciones realizadas mediante la tasa de respuesta obtenida en el DLQI (Dermatology Life Quality Index), con una reducción 5 puntos desde el nivel basal. En el estudio SUNSHINE, los dos regímenes de secukinumab tuvieron mayores tasas de respuesta, en comparación con placebo (48% en ambos grupos de secukinumab vs. 29% del grupo placebo), a la semana 16.3
En el estudio SUNRISE, también se registraron mayores tasas de pacientes con respuesta en los grupos que recibieron secukinumab contra lo observado con placebo (38% en el grupo secukinumab cada 2 semanas, 47% en el grupo de secukinumab cada 4 semanas y 32% en el grupo placebo). Las diferencias se mantuvieron hasta la semana 52.3

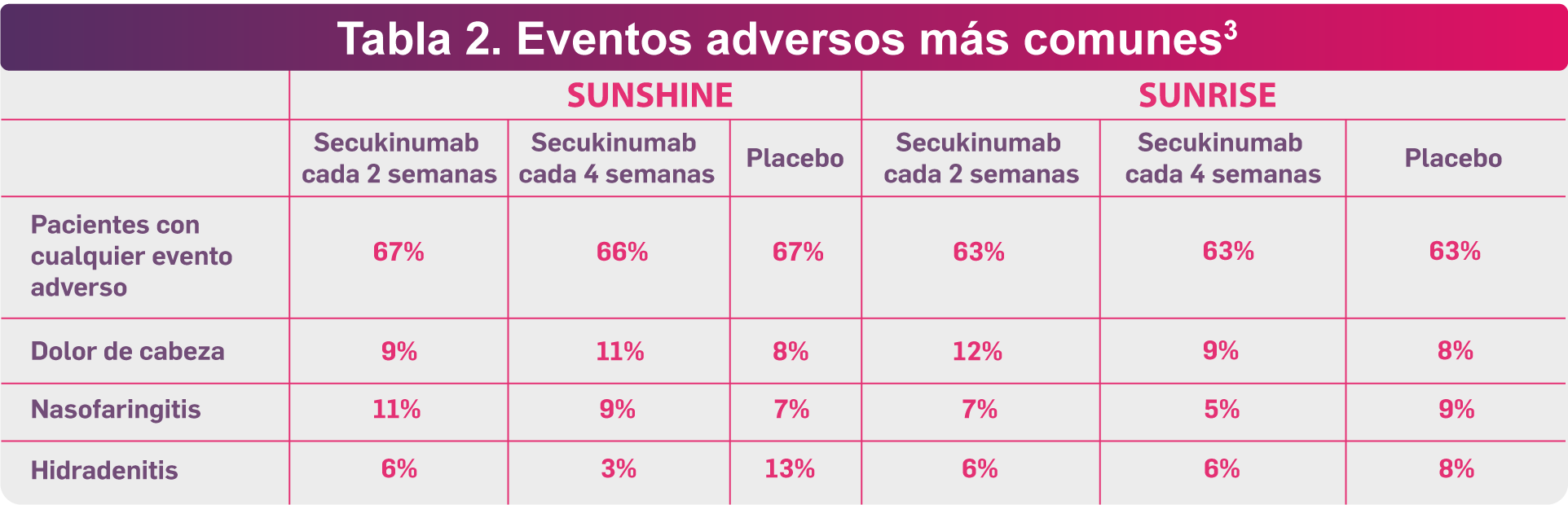
En ambos ensayos, se demostró que los dos regímenes de tratamiento con secukinumab fueron bien tolerados. En la tabla 2, se reportan los eventos adversos más comunes que fueron reportados durante el seguimiento de los pacientes, entre ellos destacan el dolor de cabeza y la nasofaringitis; sin embargo, no fueron superiores a los reportados en el grupo con placebo.3
Los efectos adversos serios fueron infrecuentes y generalmente ocurrieron en cantidades similares entre los tres grupos, en ambos estudios, tanto en la semana 16 como en la semana 52 (Tabla 3).3
De los eventos reportados, el más común fue el empeoramiento de la hidradenitis y los eventos adversos serios no fatales no superaron el 3%, lo cual no fue superior a lo reportado en el grupo de placebo. Las infecciones evaluadas, tumoraciones malignas, tumoraciones inespecíficas, eventos cardiovasculares mayores, enfermedad inflamatoria intestinal, fueron consistentes en ambos estudios y no fueron mayores a los que presentó el grupo placebo.3