


En la siguiente tabla se muestran las pautas para la reducción de dosis de PIQRAY® en caso de que aparezcan eventos adversos severos.2


Una de las toxicidades más comunes del tratamiento con PIQRAY® es la erupción cutánea, que se ha reportado en 45 a 64% de los pacientes.3
La toxicidad en la piel que ocurre con los bloqueadores de PI3K se debe a la desregulación de la diferenciación y apoptosis de los queratinocitos. Los eventos adversos cutáneos aparecen típicamente dentro de los primeros dos meses de haber iniciado el tratamiento.4
Se debe informar a los pacientes sobre los posibles signos y síntomas de las reacciones cutáneas severas y, en caso de que se presenten, se debe interrumpir el tratamiento con PIQRAY® hasta que se haya determinado la etiología de la reacción.2
Cuando se confirmen reacciones cutáneas severas, se debe suspender definitivamente la administración de PIQRAY® y este tratamiento no debe reiniciarse en pacientes que hayan presentado reacciones cutáneas severas con anterioridad.2 En la siguiente tabla se muestra la forma recomendada para proceder en caso de que aparezcan reacciones cutáneas en pacientes que reciben tratamiento con PIQRAY®.

Uno de los eventos adversos más comunes de PIQRAY® es la hiperglucemia.6
La hiperglucemia se presenta en etapas tempranas del tratamiento con PIQRAY®, con una mediana de alrededor de 2 semanas de haber iniciado la terapia.6
Se debe a que el bloqueo de la PI3K- inhibe las acciones metabólicas de la insulina, lo que impide la captación de glucosa por el músculo esquelético y el tejido adiposo y promueve la glucogenolisis hepática, llevando al aumento de la glicemia y a una liberación compensatoria de insulina.6
El evento adverso de hiperglucemia puede clasificarse en grados, según los niveles de glucosa plasmática en ayunas:5
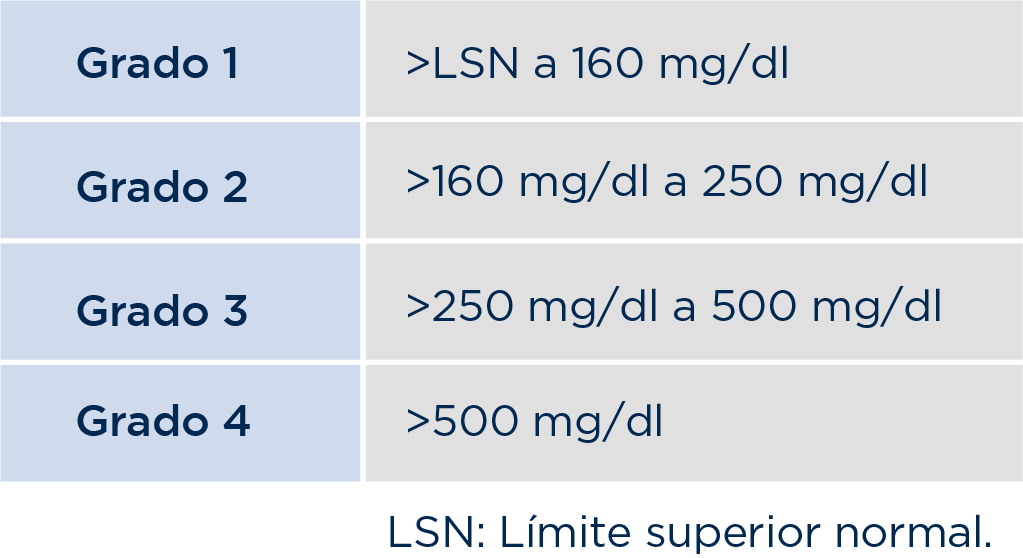
Antes de comenzar el tratamiento con PIQRAY®, se debe relizar una evaluación exhaustiva del riesgo de hiperglucemia en todos los pacientes. Los que tengan alto riesgo, deben ser referidos con un endocrinólogo para que lleven el seguimiento adecuado.6
La presentación de hiperglucemia puede requerir:6
- Reducciones en las dosis de PIQRAY®.
- Interrupción o descontinuación del tratamiento.
La detección y tratamiento tempranos de la hiperglucemia pueden ayudar a controlar los niveles de glucosa en sangre y permitir una mejor utilización y efectos de PIQRAY®.6
El tratamiento puede incluir:6
- Modificaciones del estilo de vida (incluyendo una dieta baja en carbohidratos)
- Uso de fármacos antidiabéticos.
Estudio METALLICA
El estudio METALLICA, de fase II, prospectivo, multicéntrico y abierto, tuvo como objetivo principal investigar la incidencia de eventos de hiperglucemia de grado 3–4 en 68 pacientes tratados con PIQRAY® + fulvestrant o un inhibidor de aromatasa, y que también recibieron metformina para prevenir los episodios de hiperglucemia, durante los primeros dos ciclos de la terapia con PIQRAY® (8 semanas).7,8
Los pacientes incluidos en el ensayo METALLICA se aleatorizaron en dos cohortes, según la glicemia basal. La cohorte A incluyó pacientes con GPA <100 mg/dL y hemoglobina glucosilada (HbA1c) <5.7%, mientras que la cohorte B incluyó a aquellos con GPA de 100-140 mg/dL y/o HbA1c de 5.7 a 6.4%. Todos los pacientes iniciaron tratamiento con metformina oral en dosis de 1000 mg/día en los días 1 a 3, con escalamiento a 2000 mg/día posteriormente, junto con terapia endocrina (fulvestrant [92.6%], letrozol o exemestano).
A partir del día 8 del ciclo, se añadió el tratamiento con PIQRAY® 300 mg/día por vía oral hasta el final del estudio, progresión de la enfermedad o toxicidad inaceptable.8
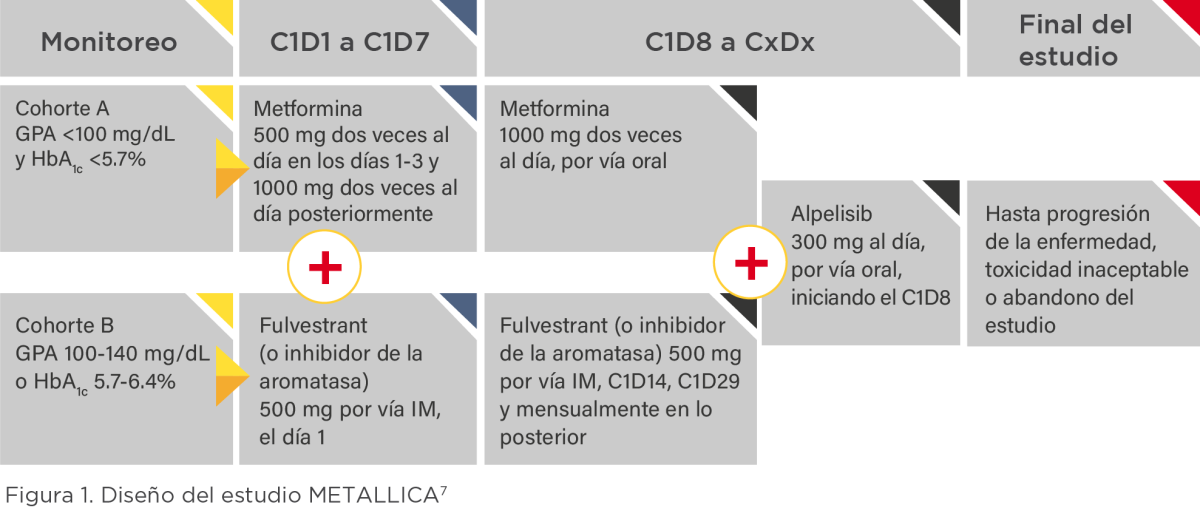
Terminado el período de estudio, se observó que solo 1 paciente (2.1%; IC 95%, 0.8–9.5; p<0.001) de la cohorte A y 3 pacientes (15%; IC 95%, 4.5–33; p=0.012) de la cohorte B experimentaron episodios de hiperglucemia de grado 3-4 en los primeros dos ciclos de tratamiento. No se reportaron discontinuaciones del tratamiento con PIQRAY® debido a la hiperglucemia durante los dos primeros ciclos del tratamiento.8
Los autores concluyeron que el uso profiláctico de la metformina reduce de manera importante la incidencia y severidad de la hiperglucemia relacionada con el tratamiento de PIQRAY®, sin que se detectaran toxicidades adicionales, por lo que sugiere que se considere como un régimen estándar en pacientes con cáncer de mama avanzado con mutación de PIK3CA, HR+/HER2–, que reciben tratamiento con PIQRAY® más fulvestrant u otra terapia endocrina.8

Neumonitis
En estudios clínicos de PIQRAY® se notificaron casos de neumonitis como evento adverso del tratamiento, algunos de ellos de intensidad severa. Por ello, se debe indicar a los pacientes que notifiquen inmediatamente cualquier síntoma respiratorio nuevo o cualquier complicación.2
En pacientes con síntomas respiratorios nuevos, que presenten complicaciones o que tengan sospecha de neumonitis, se debe interrumpir inmediatamente el tratamiento con PIQRAY® y es necesario realizar una evaluación en busca de neumonitis.2
Hay que contemplar el diagnóstico de neumonitis no infecciosa en pacientes con signos y síntomas respiratorios no específicos (como hipoxia, tos, disnea o infiltrados intersticiales en los estudios radiológicos) y cuando se hayan excluido causas infecciosas, neoplásicas y de otro tipo mediante métodos de diagnósticos adecuados. El tratamiento con PIQRAY® se debe suspender de forma definitiva en todos las pacientes con neumonitis confirmada.2
Diarrea
Es necesario monitorear a los pacientes tratados con PIQRAY® para detectar diarrea, dolor abdominal y presencia de moco o sangre en las heces.2 En la siguiente tabla se muestran las características que determinan el grado de este evento adverso:5

El tratamiento con PIQRAY® se ha asociado con casos de diarrea severa que puede derivar en deshidratación y lesión renal aguda, los cuales se resuelven con intervención adecuada.
La diarrea se ha detectado en 59.5% de los pacientes tratados con PIQRAY®.2
La severidad de la diarrea o de la colitis determinará si hay que interrumpir temporalmente la administración, reducir la dosis o suspender de forma definitiva el tratamiento con PIQRAY®.2
Modificación de la dosis de PIQRAY® según el grado de diarrea y medidas para el manejo del evento adverso.5

Toxicidad fetal
De acuerdo a las observaciones de estudios realizados en modelos animales y conforme al mecanismo de acción de PIQRAY®, este tratamieto puede causar daño fetal si se administra durante el embarazo.2
No se han realizado estudios adecuados y bien controlados en mujeres embarazadas. Los estudios en ratas y conejos han demostrado que la administración oral de PIQRAY® induce embriotoxicidad, fetotoxicidad y teratogenicidad. Se ha observado mayor incidencia de pérdidas luego de la implantación, disminución del peso fetal y aumento de las incidencias de anomalías fetales, incluso con dosis bajas.2
PIQRAY® no debe utilizarse durante el embarazo, a menos que los beneficios para la madre justifiquen los riesgos para el feto. Si PIQRAY® se utiliza durante el embarazo, se debe informar a la paciente del posible riesgo para el feto.2
Otros eventos adversos
En caso de otras reacciones adversas, la recomendación para el ajuste de las dosis de PIQRAY® es la siguiente:2

En caso de pancreatitis de grado 2 y 3, interrumpir la dosis de PIQRAY® hasta la recuperación a grado ≤1 y reanudar la administración en el nivel de dosis inmediatamente inferior. Solo reducir la dosis una vez. En caso de reaparición de la toxicidad, suspender de forma definitiva la administración de PIQRAY®.2
Para elevación total de bilirrubina de grado 2, interrumpir la administración de PIQRAY® hasta que el grado sea ≤1 y reanudarla en el mismo nivel de dosis si se resuelve en ≤14 días o reanudar la administración en el nivel de dosis inmediatamente inferior si se resuelve en >14 días.2
Alteraciones en pruebas de laboratorio
Los eventos adversos del tratamiento con PIQRAY® sobre los resultados de las pruebas de laboratorio, observados durante los estudios clínicos de fase 3 y en la experiencia posterior a la comercialización, se muestran en la siguiente tabla:2

*No se observaron eventos adversos de grado 4.











